La recherche sur la maladie de Batten (CLN)
La recherche médicale sur les maladies rares implique de nombreux acteurs, aux compétences très différentes. Les différentes étapes qui mènent à la commercialisation d'un traitement sont complexes, mais bien établies.
Cette page présente les grandes étapes de la recherche dans le cadre de la maladie de Batten. L'auteur de cette page n'est pas chercheur en génétique ou en biologie, mais a pu collecter ces informations en discutant avec des chercheurs de ces domaines, notamment à l'occasion de l'édition 2017 de la BDFA Family Conference.
Le tableau ci-dessous permet de naviguer entre les différentes parties du site internet qui décrivent chacune des étapes de la recherche de thérapie. Dans la suite de cette page, un aperçu général de cette série d'étapes est décrit, afin d'en comprendre les liens et les temporalités.
Les principales étapes, de l'idée initiale à la commercialisation
La recherche scientifique peut avoir plusieurs motivations, mais les familles de patients sont principalement intéressées à la mise à disposition du grand public de traitements pour la maladie. Le cheminement est souvent très long entre l'arrivée d'une idée et la commercialisation d'un traitement.
À l'occasion de l'édition 2017 de la BDFA Family Conference, un chercheur de l'institut d'ophtalmologie de Londres a partagé son expérience du processus. On peut considérer qu'il y a cinq étapes principales avant commercialisation :
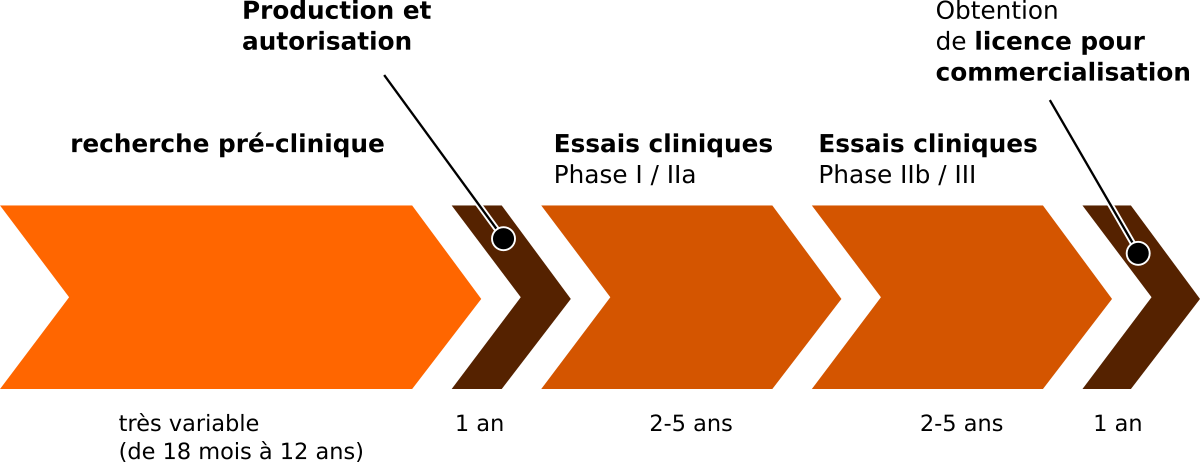
Les principales étapes du développement d'un traitement médical
- La recherche pré-clinique : pendant cette étape, on part d'une idée originale, et on explore scientifiquement tous les aspects de cette piste, depuis sa réalisation jusqu'aux possibles conséquences non désirées. D'après l'expérience du laboratoire de thérapie génique de l'institut d'ophtalmologie, cette étape a pu prendre 18 mois quand toutes les circonstances étaient réunies, ou plus de 12 ans quand le sujet d'étude était complexe.
- La production et l'autorisation : une fois qu'une approche semble pertinente, on se prépare aux essais cliniques. Il faut pour cela produire le traitement en assez grande quantité, et en parallèle obtenir l'autorisation des autorités nationales pour pratiquer ces tests cliniques. Cette étape prend en général environ un an.
- Premiers essais cliniques, phase I et IIa : pendant cette première étape, on utilise un protocole très précis pour tester le traitement sur quelques patients. Dans cette étape, on étudie la dose optimale, et les possibles effets secondaires non désirés. Cette étape peut prendre de 2 à 5 ans, suivant le type de traitement étudié.
- Essais cliniques, phase IIb et III : pendant cette première étape, on utilise un protocole plus large pour tester le traitement sur un nombre plus important de patients. Dans cette étape, on compare l'efficacité du traitement, par rapport à d'autres solutions, ou à un placebo. Cette étape peut prendre de 2 à 5 ans, suivant le type de traitement étudié.
- Démarches pour l'obtention d'une licence de commercialisation : cette étape est spécifique à chaque pays ou union de pays, et prend généralement une année.
Dans certaines situations, il est possible d'obtenir assez tôt des résultats intermédiaires lors de la première étape des essais cliniques. Dans ce cas, il arrive que l'on déclenche la deuxième étape alors que la première n'est pas pleinement finalisée, ce qui peut réduire un peu la durée avant commercialisation d'un traitement.
À l'occasion du week-end des familles VML 2019, le film Explique-moi les essais cliniques a été projeté. Il propose le témoignage de patients, qui racontent leur participation à ces essais cliniques.
Financement de la recherche de traitements
Dans la suite de ce document, il sera principalement question de l'étape de recherche pré-clinique, d'un point de vue scientifique.
Cependant, les essais cliniques ou encore les choix d'orientation des activités de recherche sont des étapes importantes, et l'aspect financier est souvent un paramètre bloquant.
Si les financeurs publics tel que l'Union Européenne avec Horizon 2020 soutiennent les activités de recherche, ils n'ont pas en général les moyens d'orienter finement les choses. La société civile dispose parfois de leviers d'action pour ces financements. Les associations de patients comme VML ou BDFA collectent des financements, et choisissent attentivement les explorations scientifiques qu'elles soutiennent.
Des événements comme le Téléthon sont un levier de financement important, mais il existe aussi des initiatives privées plus spécifiques, telle celle de Gordon Gray, un producteur de films, père de deux jeunes filles atteintes de CLN6, dont la fondation a collecté 3,5 millions de dollars pour la recherche d'une thérapie génique à cette maladie.
Commercialisation des traitements en Europe
Dans les pays de l'Union Européenne, l'autorisation de commercialisation est unifiée. Les dossiers sont déposés auprès de l'Agence Européenne du Médicament, et évalués par des experts européens.
Cependant, la prise en charge partielle ou complète, ainsi que le prix de commercialisation est une décision spécifique à chaque pays. Dans chaque pays, le délai entre l'autorisation de mise sur le marché européenne et la décision finale pour le prix et remboursement peut être de plusieurs mois, voire plusieurs années lorsque le prix proposé ne convient pas à l’état ou aux firmes pharmaceutiques, et que des négociations s’éternisent. Ces procédures sont très différentes d'un pays européen à l'autre.
En France, il arrive qu'une autorisation temporaire d'utilisation soit délivrée, pour que les patients puissent bénéficier du traitement avant la fin des procédures nationales. En 2017, c'est le cas pour le traitement enzymatique de BioMarin.
À l'occasion du week-end des familles VML 2019, le sujet du financement des thérapies géniques a été évoquée, car pour les maladies rares, il est quasiment certain que les états ne rembourseraient pas ces thérapies. Les laboratoires sont donc plus que réticents à investir dans la recherche clinique pour obtenir les autorisations de commercialisation, car pour beaucoup d'entre eux, c'est un investissement trop risqué...